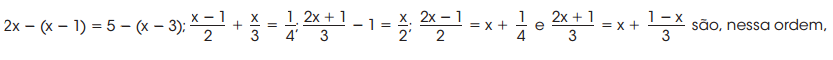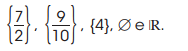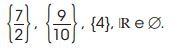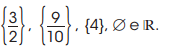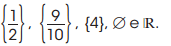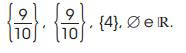Como funciona?
1
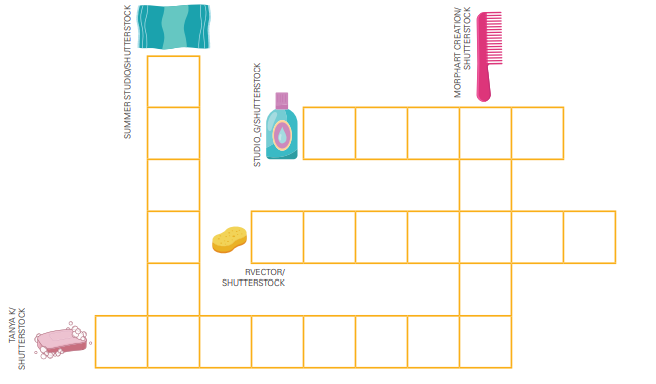
Pesquise diretamente pela barra de busca abaixo ou filtre as questões escolhendo segmento, disciplina, assunto, tipo de avaliação, ano e/ou competência.

2
Clique no botão [+] abaixo da questão que deseja adicionar a sua prova, ou arraste a questão para o organizador de prova.

3
Use a aba do organizador para excluir ou adicionar as questões de nosso banco para a sua prova.
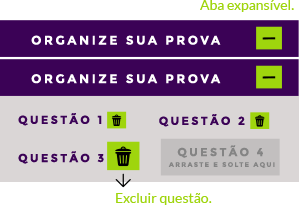

4
Quando estiver satisfeito com montagem realizada, clique em “Prévia da prova” para visualizar sua prova completa.

5
Se quiser retornar para editar algo clique em “Editar prova”. Caso esteja satisfeito, insira seu nome e e-mail nos campos e clique em “ Finalizar”.

6
Basta acessar os links da prova e gabarito que serão exibidos!

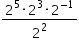 é:
é: